Gilbert-kór
Nem alkoholos zsírmáj (non-alcoholic fatty liver disease, NAFLD)
A nem alkoholos zsírmáj (NAFLD) a fejlett országokban a leggyakoribb krónikus májbetegség. Nevének megfelelően a májban történő zsírlerakódás jellemzi, de a nem alkoholos zsírmáj (NAFLD) nem alkoholos szteatohepatitisznek (non alcoholic steatohepatitis, NASH) nevezett típusában a zsírlerakódáson kívül gyulladás, kötőszövet felszaporodás (fibrózis, fibrosis), májzsugorodás (májcirrózis) és májrák is felléphet. A gasztroenterológusok és hepatológusok fontos feladata, hogy a nem alkoholos zsírmájon belül elkülönítsék a nem alkoholos szteatohepatitiszt.
A nem alkoholos zsírmáj előfordulása
A nem alkoholos zsírmáj civilizációs betegség, egyre többször diagnosztizálják a gasztroenterológusok és hepatológusok. Gyakorisága az elhízással párhuzamosan nő. Gyakran társul még 2-es típusú cukorbetegséggel, magas vérnyomással és emelkedett vérzsírokkal.
A nem alkoholos zsírmáj diagnózisa
Csak a betegek 10 %-ának vannak panaszaik, mint jobb bordaív alatti fájdalom, gyengeség, fáradékonyság. A májenzimek a betegek kb. 30 %-ában emelkedettek, ez többnyire véletlenül derül ki más okból végzett vérvétel kapcsán. A zsírmáj gyanúját képalkotó vizsgálatok megerősíthetik, ezek megbízhatósága (érzékenysége és fajlagossága) a zsírmáj szempontjából UH → CT → MR sorrendben nő. Ha más májbetegségek (mint pl. krónikus B vírus hepatitisz, krónikus C vírus hepatitisz, alkoholos májbetegség stb.) kizárhatók, fennáll egy vagy több a gyakran társuló betegségek (elhízás, magasvérnyomás, magas vérzsírok, cukorbetegség) közül és a képalkotó vizsgálatok zsírmájra utalnak, akkor tapasztalt gasztroenterológus vagy hepatológus felállíthatja a zsírmáj diagnózisát. A diagnózist Fibroscan CAP vizsgálattal lehet megerősíteni, ez a vizsgálati módszer noninvazív módon méri a májban lévő zsír és kötőszövet mennyiségét. A diagnózis minden kétséget kizáróan májbiopsziával nyert szövetminta szövettani vizsgálatával állítható fel, de erre ritkán kerítünk sort, mert a szövődmények lehetőségét magában hordó invazív vizsgálat ritkán változtatja meg a nélküle felállított diagnózist és ritkán eredményezi a kezelésre vonatkozó javaslat megváltoztatását.
A nem alkoholos zsírmáj kezelése
A zsírmáj kezelésében a testsúlycsökkentés a legfontosabb, ezt diétával és rendszeres testmozgással kell elérni. Alacsony kalória-, zsír- és szénhidrátbevitel mellett sok növényi rostot kell fogyasztani. A testmozgás aerob kell legyen és legalább heti három alkalommal 30-40 percen át tartson. Magas vérzsírok esetén a jelenlegi gasztroenterológiai és hepatológiai szakmai irányelvek javasolják a statinok, fibrátok alkalmazását. A cukoranyagcsere zavara esetén javasolható a metformin, de ezt nem javasolják a gasztroenterológiai és hepatológiai szakmai szervezetek. Adható még az antioxidáns hatású E-vitamin, silybin, S-adenozil-metionin.
Idült B vírus hepatitisz (chronicus B vírus hepatitis, krónikus B vírus hepatitis)
A több mint 6 hónapja fennálló hepatitisz B vírus okozta májgyulladást nevezzük idült B vírus hepatitisznek (chronicus B vírus hepatitisnek vagy krónikus B hepatitisznek). Ha a hepatitisz B vírussal való fertőzés felnőtt korban következik be, akkor az esetek kb. 5 %-ában válik krónikussá a fertőzés, illetve a hepatitisz. Ezzel szemben az újszülött korban bekövetkező fertőzések kb. 90 %-ban okoznak krónikus hepatitiszt. Világszerte kb. 350 millióra becsülik a hepatitisz B vírussal fertőzöttek számát. Magyarország az alacsonyan fertőzött országok közé tartozik, a lakosság kb. 0,5 %-a fertőzött hepatitisz B vírussal. Az idült B vírus hepatitisz sokszor nem okoz panaszokat, ha mégis vannak tünetek, azok többnyire enyhe általános tünetek, mint pl. fáradtság, végtagfájdalmak, kiütések, testsúlycsökkenés stb. Az un. májenzimek közül a GOT (AST) és GPT (ALT) enyhén-mérsékelten emelkedett, a GGT és AP értéke kevésbé emelkedett. A májenzimek értékei hullámzóan változnak és normálisak is lehetnek. A krónikus B vírus hepatitisz diagnózisának felállításához az un. vírus szerológia, a hepatitisz B vírus antigének (HBsAg, HBeAg) és antitestek (antiHBs, antiHBe, antiHBcIgM, antiHBcIgG) meghatározása is szükséges, de a kivizsgálásnak részét képezi a vírusszint (a vírus titer, HBV-DNS) PCR módszerrel való meghatározása és az idült B vírus hepatitis előrehaladottságának májbiopsziával vagy a nem invazív FibroScan módszerrel való meghatározása. Nagyon fontos a krónikus B vírus hepatitis kezelése, mert csak így előzhetők meg a rettegett szövődményei, mint a májzsugorodás (májcirrózis) és májrák. A hepatitis B vírus fertőzés kezelése pegilált interferonnal és nukleotid/nukleozid analógokkal (tenofovir, entecavir, lamivudin, adefovir dipivoxil stb.) történik.
Idült C vírus hepatitisz (chronicus C vírus hepatitis, krónikus C vírus hepatitisz)
Az idült C vírus hepatitisz kezelésére az utóbbi években közel 100 %-os gyógyulási arányt eredményező, szájon át szedhető, kevés mellékhatással járó úgynevezett direkt antivirális szerek állnak rendelkezésre. Az OEP (NEAK) által kiemelten (100 %) finanszírozott kezelés gyakorlatilag minden fertőzött számára elérhető, ha a kezelés végzésére jogosult hepatológus a kezelést a Hepatitisz Terápiás Bizottságnál kérvényezi. A korábban alkalmazott sok mellékhatással és csupán 50 % körüli gyógyulási aránnyal járó pegilált interferon és ribavrin kezelés már kiszorult a gyakorlatból.
Autoimmun hepatitis (autoimmun májgyulladás)
Egy elsősorban nőket (nő/féri arány 3:1) érintő idült gyulladásos májbetegség, amelyre emelkedett májenzimek, IgG szaporulat, autoantitestek és szövettani vizsgálattal un. interface hepatitis a jellemzők.
Az autoimmun hepatitis három formában jelentkezhet. A betegek egy részében heveny vírusos májgyulladásra emlékeztet a kórkép (rossz közérzet, hányinger, hányás, hasi fájdalom, majd sárgaság), máskor lappangva tünetszegényen kezdődik (levertség, fáradékonyság, étvágytalanaság, testsúlycsökkenés, hullámzó sárgaság, izületi fájdalmak), utóbbi esetben az is lehet, hogy már kezdetben a májzsugorodás tünetei vagy szövődményei észlelhetők (ascites, nyelőcső visszér.ruptura).
Autoimmun hepatitisben a következő antitestek jellemzőek: ANA (antinukleáris antitest), SMA (simaizom ellenes antitest), anti-LKM-1 (máj/vese ellenes mikroszomális antitest), anti-SLA (oldható máj antigén ellenes antitest). A betegek egy részében más autoantitestek is előfordulnak.
Szövettani vizsgálattal a legjellegzetesebb elváltozás az un. interface hepatitis (piece-meal necrosis), jellemző még a periportalis lymphocytás vagy lympho-plasmocytás infiltráció, a májsejtek duzzadása, akár kiterjedt necrosisa, rozetta képződés. Már a kezdetekben is gyakran látható fibrózis a máj szövettani vizsgálata során. Az epeutak elváltozásai azonban nem jellemzőek és többnyire más betegségre utalnak.
Az autoimmun hepatitis diagnózisa az emelkedett májenzimek, az IgG szaporulat, az autoantitestek és a májbiopszia alapján általában könnyen felállítható. A májbiopszia szükséges a kórisméhez, de a szövettani vizsgálat egyúttal a májkárosodás mértékét és előrehaladottságát is megmutatja. Kérdéses esetekben az IAIHG (International Autoimmune Hepatitis Group) pontrendszer vagy az autoimmun hepatitis egyszerűsített diagnosztikus pontrendszere használható a diagnózis felállításához (lásd a lenti táblázatokat). Az autoimmun hepatitishez gyakran társulnak más autoimmun betegségek, mint pl. pajzsmirigygyulladás, rheumatoid arthritis, colitis ulcerosa, diabetes mellitus, vitiligo, nephrosis, hypoparathyreosis, Addison-kór stb. Az autoimmun hepatitist el kell különíteni idült vírus hepatitistől, Wilson-kórtól, gyógyszer okozta májkárosodástól.
Az International Autoimmune Hepatitis Group diagnosztikus pontrendszere
|
Paraméter |
|
Pontszám |
|
|
|
|
|
Fő paraméterek |
|
|
|
nem |
nő |
+2 |
|
alkalikus.foszfatáz / GOT (GPT) arány |
> 3 |
- 2 |
|
|
1,5 - 3 |
0 |
|
|
< 1,5 |
+ 2 |
|
globulinok vagy IgG aránya |
> 2 |
+ 3 |
|
(a normális felső határához viszonyítva) |
1,5 - 2 |
+ 2 |
|
|
1 -1,5 |
+ 1 |
|
|
< 1 |
0 |
|
ANA, SMA, anti-LKM-1 titer |
> 1:80 |
+ 3 |
|
|
1:80 |
+ 2 |
|
|
1:40 |
+ 1 |
|
|
< 1:40 |
0 |
|
AMA |
pozitív |
- 4 |
|
aktív HBV vagy HCV fertőzés markerei |
pozitívak |
- 3 |
|
|
negatívak |
+ 3 |
|
hepatotoxikus gyógyszer szedése |
igen |
- 4 |
|
|
nem |
+ 1 |
|
napi átlagos alkoholfogyasztás |
< 25 g |
+ 2 |
|
|
> 60 g |
- 2 |
|
szövettan |
interface hepatitis |
+ 3 |
|
|
plazmasejtek |
+ 1 |
|
|
rozetták |
+ 1 |
|
|
fentiek hiánya |
- 5 |
|
|
epeúti elváltozások |
- 3 |
|
|
atípusos elváltozások |
- 3 |
|
|
|
|
|
Opcionális paraméterek |
|
|
|
más autoantitestek poziivitása |
SLA, pANCA, actin, ASGPR |
+ 2 |
|
HLA |
DR3 vagy DR4 |
+ 1 |
|
kezelésre adott válasz |
remisszió |
+ 2 |
|
|
relpszus |
+ 3 |
|
|
|
|
|
Pontszámok értékelése |
|
|
|
Kezelés előtt |
|
|
|
AIH |
|
> 15 |
|
valószínű AIH |
|
10 - 15 |
|
Kezelés után |
|
|
|
AIH |
|
> 17 |
|
valószínű AIH |
|
12 - 17 |
Autoimmun hepatitis egyszerűsített diagnosztikus pontrendszere
|
paraméter |
érték |
pont |
|
ANA vagy SMA |
≥ 1:40 |
1* |
|
ANA vagy SMA vagy LKM vagy SLA |
≥ 1:80 ≥ 1:40 pozitív |
2* |
|
IgG |
> normális felső határa > 1,10-szer normális felső határa |
1 2 |
|
szövettani vizsgálat |
autoimmun hepatitisnek megfelelő autoimmun hepatitisre jellemző |
1 2 |
|
vírushepatitis |
kizárható |
2 |
* autoantitestekért összesen maximum 2 pont számítható
pontszám 6 autoimmun hepatitis valószínűsíthető
pontszám ≥ 7 autoimmun hepatitis diagnózisa felállítható
Az autoimmun hepatitis kezelése immunszuppresszív gyógyszerekkel történik. Az alap a szteroid kezelés (korábban napi 30 mg prednizolon vagy napi 24 mg metilprednizolon, ma egyre inkább napi 9 mg budesonid). A szteroid mellékhatások elkerülése végett a szteroidok adagjának a csökkentésére kell törekedni, ez egy másik immunszuppresszív gyógyszer, az azatioprin (napi 1 mg/kg adagban) társításával elősegíthető. Fenntartó kezelésre az azatioprin napi 2 mg/kg adagban egymagában is elég. A gyógyszeres kezelés hossza nem határozható meg egyértelműen. Két év nyugalmi állapot után lehet megpróbálni az immunszuppresszív kezelés leállítását. Előrehaladott vagy a kezelés ellenére progrediáló esetekben májátültetés javasolt.
Primer biliaris cirrhosis (primer biliaris cholangitis, PBC)
Immunológiai hátterű, cholestasissal (epepangással) járó májbetegség. A primer biliaris cirrhosis (PBC) alapját képező elváltozás a kis intrahepaticus epeutak progresszív destrukciója. Nevével ellentétben csak a betegek egy részében áll fenn cirrhosis, sőt a mai diagnosztikus lehetőségek és módszerek mellett többnyire korai, tünetmentes stádiumban kerül sor a primer biliaris cirrhosis (PBC) felismerésére. A májtranszplatáció rutinná válásával a korábbi évtizedekben gyakran látott előrehaladott stádiumú, valóban cirrhosisos betegeket ma már csak ritkán lehet látni.
A primer biliaris cirrhosis (PBC) előfordulása, tünetei, diagnózisa
A primer biliaris cirrhosis (PBC) jellemzően középkorú nők betegsége. Prevalenciája 5-40/100.000, a férfi/nő arány 1:9, gyakoribb az északi félteke mérsékelt égövi országaiban. Környezeti és örökletes tényezők szerepe egyaránt felmerül a primer biliaris cirrhosis (PBC) kialakulásában. Általában emelkedett alkalikus foszfatáz hívja fel a figyelmet a PBC-re, ehhez magasabb koleszterinszint és kezdetben többnyire normális bilirubin szint társul. A transzamináz értékek normálisak vagy enyhén emelkedettek, a normális felső határának 2-3-szorosát nem haladják meg. A szérum IgM szint is többnyire emelkedett és az esetek 95 %-ában AMA pozitivitás mutatható ki (az AMA negatív és ANA pozitív eseteket autoimmun cholangitisnek nevezik). Májbiopsziával a diagnózis igazolása mellett megállapítható a primer biliaris cirrhosis (PBC) előrehaladottsága és kizárhatók egyéb cholestasissal járó betegségek (pl. sarcoidosis, gyógyszer vagy toxikus tényezők okozta cholestasis). Teljesen típusos esetekben szakmailag elfogadott a májbiopszia mellőzése is PBC-ben. Differenciáldiagnosztikai szempontból fontos az extrahepaticus epeutak betegségeinek (pl. choledocholithiasis, egyéb extrahepaticus epeúti elzáródások, primer sclerotisáló cholangitis) ERCP (endoscopos retrograd cholangio-pancreatographia) vagy MRCP (mágneses rezonancia cholangio-pancreatographia) útján való kizárása. Kevés tünettel jár a PBC, a legjellemzőbb a viszketés, ezen kívül fáradtság és az előrehaladott esetekben icterus léphet fel.
A primer biliaris cirrhosis (PBC) szövődményeként portalis hypertensio alakulhat ki, oesophagus varixok jelenhetnek meg még a cirrhosis kialakulása előtt, ezt a portális terek gyulladása, microthrombusok kialakulása magyarázhatja. Az oesophagus varixok el is tűnhetnek, ha a primer biliaris cirrhosis kezelése a szövettani elváltozások javulásához vezet. A primer biliaris cirrhosisban fennálló tartós cholestasis következményeként a zsírban oldódó vitaminok felszívódása zavart szenved, a PBC-s betegek 33 %-ában A-vitaminhiány, 13 %-ában D-vitaminhiány, 8 %-ában K-vitaminhiány, 2 %-ában E-vitaminhiány mutatható ki. Részben a vitaminhiány, részben más, egyelőre nem teljesen tisztázott tényezők következtében primer biliaris cirrhosisban gyakori az osteoporosis is, ezért rendszeres ODM vizsgálatuk javasolt.
A primer biliaris cirrhosis (PBC) standard kezelése ma napi 13-15 mg/ttkg ursodeoxycholsav (urzodeoxikólsav, UDCA; Magyarországon Ursofalk néven kerül forgalomba), egy nem toxikus, hydrophil epesav, amelynek szedésével párhuzamosan az epesav pool úgy alakul át, hogy legnagyobb mennyiségben UDCA lesz benne. Az UDCA hatására nő a primer biliaris cirrhosisos betegek túlélése, csökken az alkalikus foszfatáz és bilirubin szintje, és egyes vizsgálatok szerint a szöveti kép is javul. A prednisolon javítja a közérzetet, a laboratóriumi leleteket, a szöveti képet, de rontja a csontok ásványi anyag tartalmát, ezért a szisztémás szteroidok helyett újabban budesonid alkalmazását javasolják kombinációs kezelésben UDCA-val. Azatioprin, cyclosporin A, methotrexat és colchicin kezeléssel is vannak kedvező adatok, de az eredmények nem meggyőzőek. A 100 µmol/l feletti serum bilirubin, mint rossz prognosztikai tényező, a májátültetés indikációját jelenti primer biliaris cirrhosisban.
Primer szklerotizáló cholangitis (primer sclerotisáló cholangitis, PSC)
A primer sclerotisáló cholangitis (primer szklerotizáló kolangitisz, PSC) az intra- és extrahepaticus epeutak gyulladással és fibrosissal járó betegsége. Jellemzően fiatal férfiakban fordul elő, a férfi/nő arány 7:3. Az Egyesült Államokban becsült prevalenciája 13/100.000. Immunológiai háttere mellett örökletes és környezeti tényezők is szerepet játszanak kialakulásában. Az esetek 75 %-ában gyulladásos bélbetegség (IBD) társul a PSC-hez.
A primer szklerotizáló cholangitis (PSC) tünetei, diagnózisa
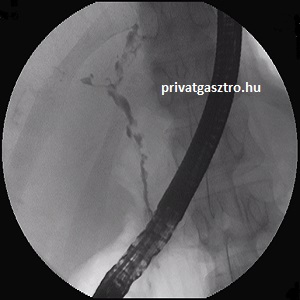 Fáradékonyság, viszketés, sárgaság, bakteriális cholangitisek hívhatják fel a figyelmet a primer szklerotizáló cholangitiszre. A laboratóriumi eltérések közül az alkalikus foszfatáz emelkedése a legjellemzőbb, a GOT és GPT értékek kismértékben emelkedettek lehetnek, a serum bilirubin a betegség előrehaladtával és bakteriális cholangitisek idején emelkedik. Az AMA ritkán, viszont a pANCA irodalmi adatok szerint kb. 80 %-ban pozitív. MRCP-vel (mágneses rezonancia kolangio-pankreatográfia) vagy ERCP-vel (endoszkópos retrográd kolangio-pankreatográfia) láthatók a típusos, diagnosztikus értékű extra-, illetve intrahepaticus epeúti elváltozások (szegmentális szűkületek és tágulatok). A fényképen primer sclerotisáló cholangitisre jellemző súlyos elváltozások láthatók a teljes extrahepaticus epeútrendszeren: az epeutak szűkültek, kontúrjuk szabálytalan, kaliberingadozás látható. A májbiopszia nem diagnosztikus értékű, de amennyiben az extrahepaticus epeutak radiológiailag épnek bizonyulnak, abban az esetben mégis javasolt elvégzése differenciáldiagnosztikai szempontból.
Fáradékonyság, viszketés, sárgaság, bakteriális cholangitisek hívhatják fel a figyelmet a primer szklerotizáló cholangitiszre. A laboratóriumi eltérések közül az alkalikus foszfatáz emelkedése a legjellemzőbb, a GOT és GPT értékek kismértékben emelkedettek lehetnek, a serum bilirubin a betegség előrehaladtával és bakteriális cholangitisek idején emelkedik. Az AMA ritkán, viszont a pANCA irodalmi adatok szerint kb. 80 %-ban pozitív. MRCP-vel (mágneses rezonancia kolangio-pankreatográfia) vagy ERCP-vel (endoszkópos retrográd kolangio-pankreatográfia) láthatók a típusos, diagnosztikus értékű extra-, illetve intrahepaticus epeúti elváltozások (szegmentális szűkületek és tágulatok). A fényképen primer sclerotisáló cholangitisre jellemző súlyos elváltozások láthatók a teljes extrahepaticus epeútrendszeren: az epeutak szűkültek, kontúrjuk szabálytalan, kaliberingadozás látható. A májbiopszia nem diagnosztikus értékű, de amennyiben az extrahepaticus epeutak radiológiailag épnek bizonyulnak, abban az esetben mégis javasolt elvégzése differenciáldiagnosztikai szempontból.
Kis epeúti primer szklerotizáló cholangitis (kis epeúti PSC, small duct PSC)
Vannak betegek, akikben a klinikai kép, a laboratóriumi eredmények és a máj szövettani képe is primer sclerotisáló cholangitisre jellemző, de a májon kívüli (extrahepaticus) epeutakon nem látható eltérés. Ezeket a betegeket az angolszász szakirodalomban small-duct (kis epeutakat érintő) primer sclerotisáló cholangitises betegeknek nevezik. A kis epeúti primer szklerotizáló cholangitises betegek az összes PSC-ben szenvedő beteg 5-20 %-át teszik ki, 12-17 %-ukban évek során a májon kívüli (extrahepaticus) epeutakban is megjelennek elváltozások. Ennek alapján a kis epeúti PSC-t a PSC enyhe, korai formájának tartják.
A primer szklerotizáló cholangitis (PSC) szövődményei
A májcirrhosis jól ismert szövődményein kívül primer szklerotizáló cholangitis esetén epeúti stenosisok és recidiváló bakteriális cholangitisek mellett a betegek 8-15 %-ában számolni kell cholangiocarcinoma kialakulásával (diagnózisa nehéz, a 100 feletti CA 19-9 érték primer sclerotisáló cholangitises (PSC) betegben 80 %-os specificitással és szenzitivitással utal rá). Kis epeúti primer szklerotizáló cholangitisben (small duct PSC-ben) nem észleltek cholangiocarcinomát.
A primer szklerotizáló cholangitis (PSC) kezelése
A primer szklerotizáló cholangitis kezelése nagy kihívás a gasztroenterológusok, hepatológusok számára. Az ursodeoxycholsav (urzodeoxikólsav, UDCA) az egyedüli gyógyszer, mellyel kedvező tapasztalatok is voltak, de az ursodeoxycholsav napi 28-30 mg/ttkg adagban (un. emelt dózisban) való alkalmazásával kapcsolatban a betegség kedvezőtlen lefolyását is leírták. Klinikailag szignifikáns epeúti stenosis kialakulása esetén ERCP során végzett ballonos tágítás, esetleg epeúti endoprothesis behelyezése kedvező hatású lehet. A betegség definitív kezelését a májtranszplantáció jelenti, de nem szabad elfelejteni, hogy a colitis ulcerosában is szenvedő primer sclerotisáló cholangitiszes (PSC) betegekben a májtranszplantáció után megnő a vastagbélrák kialakulásának rizikója.
A primer szklerotizáló cholangitis (PSC) gondozása
A primer szklerotizáló cholangitiszben szenvedő betegek, más idült betegségekben szenvedőkhöz hasonlóan rendszeres orvosi ellenőrzésre (gondozásra) szorulnak. Ennek értelme az állapotrosszabbodás és szövődmények időben való felismerése. Állapotrossszabbodásra utalhat a láz, sárgaság, laboratóriumi leletek rosszabbodása. Szövődményként epeelfolyási akadályt képező epeúti szűkületek, epeúti bakteriális gyulladások, epeúti rosszindulatú daganat (cholangiocarcinoma), epehólyagrák és a gyulladásos bélbetegségben (IBD) is szenvedőkben a vastagbélrák léphetnek fel. Időbeni felismerésükre általában háromhavonta laboratóriumi vizsgálatok, hathavonta hasi ultrahangvizsgálat, évente CA 19-9 tumormarker vizsgálata, előrehaladott esetben 1-2 évente MRCP, un. domináns epeúti szűkület gyanúja esetén ERCP, IBD társulása esetén 1-2 évente vastagbéltükrözés javasolt.
Overlap szindróma
Az overlap szindróma megnevezést legelerjedtebben a primer biliaris cirrhosis (PBC) és autoimmun hepatitis, illetve primer sclerotisáló cholangitis (PSC) és autoimmun hepatitis jegyeit egyaránt viselő betegek esetén használják (ritkábban a PBC és PSC jegyeinek, illetve a chronicus C-vírus hepatitis és autoimmun hepatitis jegyeinek keveredésekor is). A PBC-s, PSC-s és autoimmun hepatitises betegek 7-9 %-ában fordul elő overlap szindróma. A GOT és GPT értékek magasabbak, mint PBC-ben vagy PSC-ben, IgM és IgG szaporulat egyaránt észlelhető és a PBC-re jellemző AMA valamint a PSC-re jellemző pANCA mellett ANA és SMA pozitivitás is kimutatható. Gyógyszeres kezelésként ursodeoxycholsav (urzodeoxikólsav, UDCA) és immunszuppresszív szerek (szteroid, azatioprin) adása javasolt. Előrehaladott esetekben májtranszplantációt kell végezni. Az overlap szindróma két betegsége nem mindig jelentkezik egyidejűleg.
Wilson-kór
A Wilson-kór a rézanyagcsere örökletes betegsége, melyet az ATP7B gén mutációi okoznak. A réz nem tud a szállító fehérjéjéhez, a coeruloplasminhoz (cöruloplazmin) kapcsolódni és ez a réznek a szervezetben való felhalmozódásához vezet.
A Wilson-kór tünetei
A többnyire 6-40 éves életkorban fellépő Wilson-kór négy kórformában jelentkezhet: májbetegség (heveny vagy idült), ideggyógyászati tünetek, acut haemolysis (a vörösvértestek szétesésével járó heveny betegség), pszichiátriai tünetek. A májenzim emelkedés többnyire enyhe vagy mérsékelt.
A Wilson-kór diagnózisa
Ha felmerül a Wilson-kór lehetősége, akkor első lépésben a coeruloplasmin, a szérum réz és a vizelet réz meghatározását kell elvégezni. Ha ezek a vizsgálatok bizonytalan eredményhez vezetnek, akkor penicillaminnal végzett terheléses vizelet réz vizsgálat javasolt. A máj érintettsége esetén a diagnózis májbiopsziával és a májszövet réztartalmának meghatározásával állítható fel. Az idegrendszert érintő kórformákban a szem réslámpa vizsgálatával igazolt Kayser-Fleischer gyűrű vagy MR vizsgálat segítheti a diagnózist. Genetikai vizsgálat is rendelkezésre áll.
|
|
Wilson-kór
|
egészséges
|
|
|
Szérum coeruloplasmin
|
0-200
|
200-350
|
mg/l
|
|
Szérum réz
|
190-640
3-10
|
700-1520
11-24
|
µg/l
µmol/l
|
|
Vizelet réz
|
100-1000
>1,6
|
<40
<0,6
|
µg/nap
µmol/nap
|
|
2x500 mg penicillaminnal
provokált vizelet rézürítés
|
>25
|
<12
|
µmol/nap
|
|
Máj réztartalma
|
>200
|
20-50
|
µg/g
|
A Wilson-kór kezelése
A Wilson-kór gyógyszeres kezelésére penicillamin, trientin, cink és ammónium tetrathiomolybdat használható. Májtranszplantációra lehet szükség súlyos dekompenzált májbetegekben, főleg, ha nem reagálnak a gyógyszeres kezelésre és fulmináns májelégtelenségben.
A kezelés eredményességének megítélése
A legfontosabb a tünetek és a laboratóriumi értékek javulása. A napi vizelet réz ürítés a kezelés kezdetén tapasztalt 16 µmol/nap értékről 3-8 µmol/nap értékre áll be. A kezelés eredményessége mellett szól az is, ha a penicillamin kezelés két napos felfüggesztését követően a vizelet réz 1,7 µmol/nap érték alá csökken. Ugyancsak a Wilson-kóros beteg kezelésének eredményességére utal, ha az un. szabad (nem coeruloplasminhoz kötött) réz szérum szintje nem haladja meg a 15 µg/dl értéket. A nem coeruloplasminhoz kötött réz szérum szintje az alábbiak szerint számítható ki: a szérum réz µg/dl mértékegységben megadott értékéből kivonjuk a coeruloplasmin mg/dl mértékegységben megadott értékének háromszorosát (a coeruloplasmin 0,3 % rezet tartalmaz); az eredményt µg/dl értékben kapjuk meg.
Májrák (májsejtrák, hepatocellularis carcinoma, HCC)
A májrák a harmadik leggyakoribb daganatos halálozási ok. A hepatitisz vírussal fertőzöttek magas száma miatt a májrák leggyakrabbam Afrikában és Délkelet Ázsiában fordul elő. Az utóbbi években a nyugati világban is egyre több a májrák, elsősorban a nem alkoholos steatohepatitis (NASH) gyakoribbá válásának tulajdoníthatóan.
Májrákra hajlamosító tényezők:
májzsugorodás (májcirrózis, májcirrhosis), idült B vírus hepatitis, idült C vírus hepatitis, alkoholos májbetegség, nem alkoholos steatohepatitis, haemochromatosis, Wilson-kór, aflatoxin.
A májrák diagnózisa
Minél korábban fedezik fel a májrákot, annál hosszabb túlélés várható. A májrák korai felfedezése érdekében a májzsugorban – mint a májrák legfontosabb hajlamosító tényezőjében - szenvedőket félévente hasi ultrahangvizsgálattal szűrni kell. Amennyiben 1 cm-nél nagyobb átmérőjű gócos elváltozás derül ki, akkor további képalkotó vizsgálatokat, mint kontrasztanyagos CT, kontrasztanyagos MR vagy kontrasztanyagos UH vizsgálatot javasolt végezni. Akiknek nincs májzsugorodásuk, de májrákra hajlamosító más betegségben szenvednek, azokat is szűrni kell hasi ultrahangvizsgálattal, de erre nincs általánosan elfogadott ajánlás; a gondozásukat végző hepatológus / gasztroenterológus belátása szerint kell azt végezni. Az esetükben fellelt 1 cm-nél nagyobb átmérőjű gócos elváltozások esetén is a fentieknek megfelelően további vizsgálatokat kell végezni. Ha a képalkotó vizsgálatok májrákra típusos elváltozást írnak le, akkor nem feltétlenül szükséges a májrák diagnózisát célzott (ultrahangvezérelt, CT vezérlelt) biopsziával vagy finomtű aspirációval (FNA) megerősíteni. A májrák diagnózisában nincs ideális tumormarker, de az alfa-foetoproteint (AFP-t) mégis használják a mindennapi gyakorlatban. Hátránya, hogy éppen a kis átmérőjű májrákok esetében, ahol a képalkotó vizsgálatok (UH, CT, MR) nem elég egyértelműek, épp ott bizonytalan az AFP szint emelkedése is. Ezért az amerikai ajánlásokban az AFP-t már nem javasolják a májrák esetében diagnosztikus kritériumként figyelembe venni, csak a betegség lefolyásának, a kezelésre adott válasznak a követésére, illetve a prognózis megítélésére.
A májrák kezelése
A betegek kb. 20 %-ában kivitelezhető a májrák műtéti eltávolítása (resectio, rezekció), melynek a daganat mérete, elhelyezkedése és az egyidejűleg fennálló májzsugorodás szab határt. A jól sikerült, un. kuratív (gyógyító) műtétek után is 5 év elteltével 70 %-ban újul ki a májrák (ami vagy igazi recidíva, kiújulás vagy a májzsugorodás talaján kialakuló másik májrák). Ezek a nehézségek májtranszplantációval (májátültetéssel) hidalhatók át, melynek során nem csak a májrák kerül eltávolításra, hanem a rákmegelőző állapotot jelentő cirrhoticus máj (zsugormáj) is. Az un. milánói kritériumok (egy daganat esetén annak átmérője ne haladja meg az 5 cm-t, három daganat esetén azok átmérője egyenként ne haladja meg a 3 cm-t) betartása esetén, májátültetés után a májrákos betegek 4 éves túlélése 75 % körüli. Ha a májrák rezekciója valamilyen okból (társbetegségek, előrehaladott májzsugor, kifejezett portalis hypertonia, illetve portalis kollaterális keringés) nem kivitelezhető és nincs lehetőség megfelelő időben májtranszplantációra sem, akkor helyi ablációs kezelések jönnek szóba: a rádiofrekvenciás abláció (RFA) és a percutan alkoholos infiltráció (PEI). Az RFA során termikusan károsítják a májrákot, többnyire egy ülésben elvégezhető a beavatkozás. A PEI során tömény alkoholt fecskendeznek a májrákba, ami a daganatszövet elhalásához vezet, általában több alkalommal kell végezni. 2 cm átmérőig a két beavatkozás egyenértékű, 2-5 cm átmérőjű májrákok esetén az RFA hosszabb túlélést biztosít és ritkább helyi kiújulással (lokális recidíva) jár. 5 cm-t meghaladó átmérőjű májrákok esetén más kezelési módot javasolt választani. Mindkét ablációs módszer esetén 5 év alatt 70 %-os lokális recidívával kell számolni és 2 % esély van a szúrcsatornában kialakuló áttétek (metastasisok, metasztázisok) lehetőségére. A nem rezekálható és ablációs kezelésre sem alkalmas májrákok kezelésére transarteriális chemomebolisatio (transzarteriális kemoembolizáció, TACE) jön szóba. TACE során a májrák döntően arteriális vérellátását kihasználva általában a combverőérből (arteria femoralis) kiindulva egy kanüllel a májrákot ellátó artériába juttatják be a kemoterápiás gyógyszert, majd a májrákot ellátó artériát erre alkalmas részecskék bejuttatásával elzárják, embolizálják. A TACE egy továbbfejlesztett változata, amikor kemoterápiás gyógyszert kibocsátó gyöngyökkel (drug-eluting bead) zárják el a májrákot vérrel ellátó artériát. Hasonló elven alapul a SIRT (selective internal radiation therapy, selective intraarterial radiotherapy), melynek során a májrákot ellátó artériába ittrium izotópot (90Y) tartalmazó részecskéket juttatnak be. Előrehaladott májrákos betegek kezelésére - akiknek esetében a májrák műtéti eltávolítása, a májátültetés, az ablációs kezelések és a TACE sem jön szóba - a várható túlélést igazoltan növelő tirozinkináz gátló sorafenibet alkalmazzák. Ennek ellenére az előrehaladott májrákos betegek túlélése 12 hónap alatt van. A májrákban szenvedők kezeléséről közösen kell dönteni a betegnek, hepatológusnak / gasztroenterológusnak, májsebésznek, intervenciós radiológusnak és onkológusnak.
Terhességi cholestasis (terhességi kolesztázis, terhességi epepangás)
Kialakulásának oka nem tisztázott. Bár korábban is felléphet, a terhességi cholestasis többnyire a terhesség harmadik trimeszterében jelentkező kórkép.
A terhességi cholestasis tünetei
Legjellemzőbb tünete a viszketés, ez éjszaka kifejezettebb. Sárgaságot ritkán okoz, de a vér bilirubin szintje egyes betegekben emelkedett lehet. A glutamát oxálacetát transzamináz (GOT) és glutamát piruvát transzamináz (GPT) értékek emelkedettek, néha az 1000 IU/l értéket is meghaladják, így nehézzé teszik az akut hepatitistől, vírusos hepatitistől való elkülönítést. A γ-glutamil transzpeptidáz (GGT, γ-GT) érték normális vagy normálishoz közeli, az alkalikus foszfatáz (AP, ALP) mérsékelten emelkedett. A panaszok és a laboratóriumi leletek hullámzóak lehetnek.
A terhességi cholestasis elkülönítő diagnózisa
El kell különíteni más, terhességre jellemző májbetegségektől (preeclampsiához társuló májbetegség, HELLP szindróma, heveny terhességi zsírmáj), más cholestasissal (epepangással) járó betegségektől, mint primer biliaris cirrhosis, primer sclerotisáló cholangitis, benignus rekurráló cholestasis, illetve egyéb, szintén a májenzimek eltérésével járó betegségektől, mint vírusos májgyulladás, toxikus májkárosodás, epeúti elzáródás.
A terhességi cholestasis kezelése
A terhességi cholestasis fokozza a magzati distressz, a koraszülés, halvaszülés kockázatát. Ezek az anya és magzat szoros megfigyelésével, szükség esetén a terhesség idő előtti befejezésével általában megelőzhetők. Napi 15-25 mg/ttkg ursodeoxycholsav (Ursofalk) adása kedvező a terhességi cholestasis tüneteinek és a laboratóriumi eltéréseinek (májenzimek, bilirubin) alakulására. A panaszok és a laboratóriumi eltérések a szülést követően többnyire teljes mértékben megszűnnek. A szülés után újabb hepatológiai vizsgálat javasolt más májbetegség lehetőségének tisztázása céljából.
A terhességi cholestasis a későbbi terhességek során 60-70 %-os gyakorisággal ismétlődik. Terhességi cholestasison átesett nőkben fogamzásgátlók szedésekor is cholestasis léphet fel.
Heveny májgyulladás (akut hepatitisz)
Alkoholos májbetegség
Nem alkoholos szteatohepatitisz (NASH)
Zsírmáj (szteatózis)
Idült C vírus hepatitis
Májzsugorodás (májcirrhosis, májcirózis)
Haemochromatosis (hemokromatózis)


